血管はどのように形成されるのか? 血管を作りそして壊す。
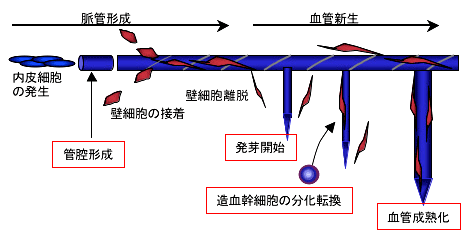
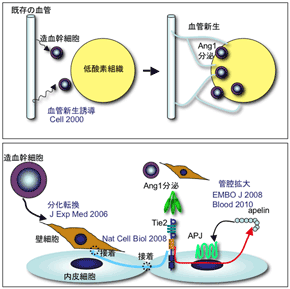 慢性炎症や、これらを発生母体とすることの多い腫瘍においては、病変部に形成される新規血管が病態の悪化を誘導することが知られている。近年、このような血管新生のメカニズムが徐々に明らかとなってきており、血管新生の分子機序を応用した血管制御法により、様々な病態を改善する治療法の開発が進められてきている。我々は従来より、造血系と血管系の発生の関連性を研究してきており、造血幹細胞が分泌するangiopoietin-1(内皮細胞に発現する受容体Tie2の結合因子)が血管新生を誘導する分子メカニズムを明らかにしたのを初め(Cell 102:2000)、血液細胞が発現するneuropilin-1が血清中のVEGF(血管内皮細胞成長因子)と結合して、外来的に内皮細胞上のVEGF受容体、Flk-1を活性化して血管新生を誘導することを発見し、報告してきた(Blood 97:2001, 101:2003 )。また、最近では、造血幹細胞が血管新生を誘導した後に、壁細胞に分化して血管構造の安定化に寄与する分子メカニズムを明らかにした(JEM 203:2006)。壁細胞化を伴い、血管は徐々に血管径を拡大化して成熟化する。その際に、壁細胞や血管近傍に集合している造血幹細胞はangiopoietin-1を分泌して、血管内皮細胞からapelinを分泌させ、自らのAPJをオートクラインループにより活性化して、内皮細胞の集塊を大きくすることにより血管の管腔径を拡大化させることが判明した(EMBO J 27:2008, Blood 115:2010)。今後さらに血管細胞の、特に血管内皮細胞の中のheterogeneity (不均質性)や、動静脈パターニングの詳細な解析、また血管形成を正や負に制御する分子の単離により、新しい血管制御の方法論の確立に努めたい。
慢性炎症や、これらを発生母体とすることの多い腫瘍においては、病変部に形成される新規血管が病態の悪化を誘導することが知られている。近年、このような血管新生のメカニズムが徐々に明らかとなってきており、血管新生の分子機序を応用した血管制御法により、様々な病態を改善する治療法の開発が進められてきている。我々は従来より、造血系と血管系の発生の関連性を研究してきており、造血幹細胞が分泌するangiopoietin-1(内皮細胞に発現する受容体Tie2の結合因子)が血管新生を誘導する分子メカニズムを明らかにしたのを初め(Cell 102:2000)、血液細胞が発現するneuropilin-1が血清中のVEGF(血管内皮細胞成長因子)と結合して、外来的に内皮細胞上のVEGF受容体、Flk-1を活性化して血管新生を誘導することを発見し、報告してきた(Blood 97:2001, 101:2003 )。また、最近では、造血幹細胞が血管新生を誘導した後に、壁細胞に分化して血管構造の安定化に寄与する分子メカニズムを明らかにした(JEM 203:2006)。壁細胞化を伴い、血管は徐々に血管径を拡大化して成熟化する。その際に、壁細胞や血管近傍に集合している造血幹細胞はangiopoietin-1を分泌して、血管内皮細胞からapelinを分泌させ、自らのAPJをオートクラインループにより活性化して、内皮細胞の集塊を大きくすることにより血管の管腔径を拡大化させることが判明した(EMBO J 27:2008, Blood 115:2010)。今後さらに血管細胞の、特に血管内皮細胞の中のheterogeneity (不均質性)や、動静脈パターニングの詳細な解析、また血管形成を正や負に制御する分子の単離により、新しい血管制御の方法論の確立に努めたい。
組織構築の中心、幹細胞。その自己複製と休眠の謎に迫る
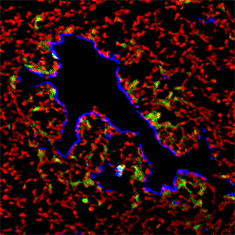 造血系が血管形成に関与するのとは反対に、血管系が血液細胞、特に造血幹細胞の増殖・分化に関ることも明らかになりつつある。我々は以前、成体型の造血幹細胞が最初に増殖する現場は、胎児と卵黄嚢間の唯一の血流回路である臍腸間膜動脈内の血管内皮細胞上であることを発見、報告した(Immunity 9:1998)。近年、幹細胞ニッチ(生態学的適所)の概念がトピックスとなってきており、ニッチ現場では幹細胞性(未分化性、自己複製能)が維持されるとされている。造血幹細胞の場合、骨髄内では骨梁領域の骨芽細胞に幹細胞が接着し、静止期の状態を維持していると考えられている。我々は上述したように、造血幹細胞の増殖は血管領域で生じるという仮説に立脚し、血管領域と骨芽細胞領域での幹細胞のふるまいを、分子レベルで解析し、幹細胞の未分化性、自己複製能、長期生存といういわゆるstemness(幹細胞らしさ)の本質にせまりたいと考えている。2005年に単離したPSF1という分子は(MCB 25:2005)、休眠中の造血幹細胞には発現せず、自己複製の旺盛な造血幹細胞に発現し、その遺伝子欠損が半分でも生じると、骨髄破壊後の急速な幹細胞増殖に致命的な障害をあたえる(Blood 113:2009)。そして種々の組織の幹細胞系列にPSF1の発現が認められ、がん幹細胞にも発現する。このPSF1の発現をモニターして解析した結果、がん幹細胞と考えられる細胞が、がん組織の周囲の血管領域を生態学的適所(ニッチ)として利用して、自己複製を営むことが判明した(Cancer Research 70: 2010, 図中、EGFP陽性細胞が、がん幹細胞、血管内皮細胞は青色を呈する細胞)。現在、PSF1と複合体を形成する分子群、PSF2, PSF3, SLD5のクローニングも終え、これらの遺伝子発現の制御と、発現解析により、がん幹細胞や正常組織の幹細胞の自己複製メカニズムの解明と、幹細胞のさらなる可視化が進行中である。
造血系が血管形成に関与するのとは反対に、血管系が血液細胞、特に造血幹細胞の増殖・分化に関ることも明らかになりつつある。我々は以前、成体型の造血幹細胞が最初に増殖する現場は、胎児と卵黄嚢間の唯一の血流回路である臍腸間膜動脈内の血管内皮細胞上であることを発見、報告した(Immunity 9:1998)。近年、幹細胞ニッチ(生態学的適所)の概念がトピックスとなってきており、ニッチ現場では幹細胞性(未分化性、自己複製能)が維持されるとされている。造血幹細胞の場合、骨髄内では骨梁領域の骨芽細胞に幹細胞が接着し、静止期の状態を維持していると考えられている。我々は上述したように、造血幹細胞の増殖は血管領域で生じるという仮説に立脚し、血管領域と骨芽細胞領域での幹細胞のふるまいを、分子レベルで解析し、幹細胞の未分化性、自己複製能、長期生存といういわゆるstemness(幹細胞らしさ)の本質にせまりたいと考えている。2005年に単離したPSF1という分子は(MCB 25:2005)、休眠中の造血幹細胞には発現せず、自己複製の旺盛な造血幹細胞に発現し、その遺伝子欠損が半分でも生じると、骨髄破壊後の急速な幹細胞増殖に致命的な障害をあたえる(Blood 113:2009)。そして種々の組織の幹細胞系列にPSF1の発現が認められ、がん幹細胞にも発現する。このPSF1の発現をモニターして解析した結果、がん幹細胞と考えられる細胞が、がん組織の周囲の血管領域を生態学的適所(ニッチ)として利用して、自己複製を営むことが判明した(Cancer Research 70: 2010, 図中、EGFP陽性細胞が、がん幹細胞、血管内皮細胞は青色を呈する細胞)。現在、PSF1と複合体を形成する分子群、PSF2, PSF3, SLD5のクローニングも終え、これらの遺伝子発現の制御と、発現解析により、がん幹細胞や正常組織の幹細胞の自己複製メカニズムの解明と、幹細胞のさらなる可視化が進行中である。
